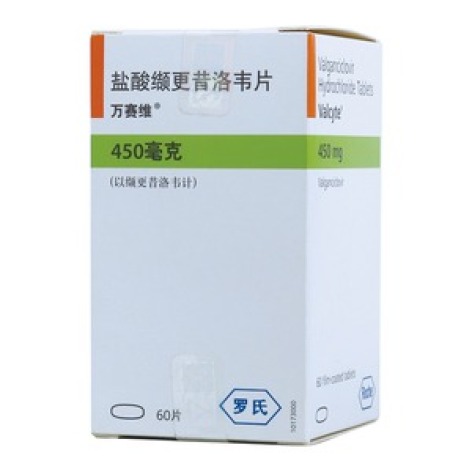
规格含量
0.45gx60片/瓶
批准文号
注册证号H20150330
生产厂家
PatheonInc.
全部规格
图文详情
说明书
| 温馨提醒 | 请仔细阅读说明书并在药师或医师指导下使用 |
|---|---|
| 药品名称 | 盐酸缬更昔洛韦片 |
| 通用名称 | 盐酸缬更昔洛韦片 |
| 商品名/品牌 | 万赛维 |
| 主要成份 | 盐酸缬更昔洛韦。其化学名为:1.L-缬氨酸,-2[(2-氨-1,6-二氢-6-氧-9H-嘌呤-9-基)甲氧基]-3-羟-丙酯,单盐酸盐。 |
| 性状 | 本品为粉红色卵圆形薄膜包衣口服片。 |
| 功效与作用 | 根据监管要求:处方审核通过后显示说明书,请下载APP开具处方单后查看。 |
| 用法用量 | 根据监管要求:处方审核通过后显示说明书,请下载APP开具处方单后查看。 |
| 副作用 | 从临床试验中获得的经验-有关盐酸缬更昔洛韦片的经验。缬更昔洛韦是更昔洛韦的前体药物,口服后迅速转化成更昔洛韦。因此已知的与更昔洛韦有关的不良反应预计也会在应用盐酸缬更昔洛韦片时发生。所有在盐酸缬更昔洛韦片临床研究中观察到的不良事件在应用更昔洛韦时也都曾观察到。AIDS患者CMV视网膜炎的治疗:在每组79例病人参加的随机应用缬更昔洛韦或静脉内更昔洛韦治疗28天(21天诱导治疗,7天维持治疗)的临床试验中,两组的安全性数据有可比性。报告最多的不良事件是腹泻、中性粒细胞减少和发热。在口服缬更昔洛韦治疗组中,腹泻、口腔念珠菌病、头痛和疲乏报告较多;而在更昔洛韦静脉制剂治疗组中,恶心和注射部位相关事件报告较多。随机研究中部分不良事件发生比率:在缬更昔洛韦治疗组(n=79),腹泻16%;口腔念珠菌病11%;头痛9%;疲乏8%;恶心8%。在静脉内更昔洛韦治疗组(n=79),腹泻10%;口腔念珠菌病6%;头痛5%;疲乏4%;恶心14%,静脉血栓和血栓性静脉炎6%。以下所示的为发生率≥(greaterthanorequalto)5%的不良事件,不论严重程度和是否与药物有关。这组数据来源于两个临床试验(n=370),研究对象为接受盐酸缬更昔洛韦片900mg每天2次诱导治疗或900mg每天1次维持治疗的CMV视网膜炎的病人。这些病人中有约65%接受缬更昔洛韦治疗超过9个月(最长时间为30个月)。两个临床试验中(n=370),在盐酸缬更昔洛韦片治疗组,不论严重程度和是否与药物有关,报告最多的不良事件(病人的%)为腹泻(38%),发热(26%),恶心(25%),中性粒细胞减少(24%)和贫血(22%)。不良事件大多数为轻度或中度。不论严重程度如何,研究者报告最多的与盐酸缬更昔洛韦片有关(包括有关,可能有关,可能无关)的事件是中性粒细胞减少(21%),贫血(14%),腹泻(13%)和恶心(9%)。器官移植患者CMV感染的预防:下表所示的为发生率≥(greaterthanorequalto)5%的不良事件,不论严重程度和是否与药物有关,这组数据来源于一个临床试验,实体器官移植患者接受缬更昔洛韦(n=244)或口服更昔洛韦(n=126),观察至停药后28天。不论严重程度和是否与药物有关,本临床试验中缬更昔洛韦片治疗组(n=244)报告最多的不良事件(患者的%)为腹泻(30%)、震颤(28%)、移植排斥反应(24%)、恶心(23%)、头痛(22%)、下肢水肿(21%)、便秘(20%)、背痛(20%)、失眠(20%)、高血压(18%)和呕吐(16%)。这些不良事件也见于口服更昔洛韦患者,且发生率相似。大多数不良事件为轻到中度。出现在实体器官移植的临床试验中而CMV视网膜炎的临床试验中没有的发生率≥(greaterthanorequalto)2%的不良事件包括高血压(18%)、血肌酐升高(10%)和代谢紊乱(高血钾)(14%)和肝功能异常(9%)。这些不良事件的发生率与口服更昔洛韦相似,可认为反映了疾病的潜在发展过程。不论严重程度如何,研究者在实体器官移植患者中报告最多的与盐酸缬更昔洛韦片有关(包括可能无关、可能有关和有关)的事件是白细胞减少(9%)、腹泻(7%)、恶心(6%)和中性粒细胞减少(5%)。在3个临床试验中(n=614),考虑与盐酸缬更昔洛韦片应用有关,但发生率不到5%的严重不良反应没有在以上列出的如下:血液和淋巴系统:全血细胞减少、骨髓抑制、再生障碍性贫血。泌尿生殖系统:肾肌酐清除率下降。感染:与骨髓和免疫系统抑制有关的事件,如局部或全身感染、脓毒血症。出血并发症:与血小板减少有关的可能威胁生命的出血。中枢和周围神经系统:惊厥,精神异常,幻觉,意识模糊,易激动。全身:缬更昔洛韦过敏反应。缬更昔洛韦治疗后的实验室异常如下:发生严重粒细胞减少(<500ANC/uL)的比例在CMV视网膜炎接受缬更昔洛韦治疗的患者(16%)高于实体器官移植后服用缬更昔洛韦(5%)或口服更昔洛韦治疗的患者(3%)。与CMV视网膜炎患者相比,实体器官移植后服用缬更昔洛韦或口服更昔洛韦治疗的患者血肌酐升高更明显。对于实体器官移植患者肾功能受损较常见。与更昔洛韦有关的不良反应:盐酸缬更昔洛韦片被迅速的转化成更昔洛韦。上面没有提到的有关更昔洛韦的不良事件如下:胃肠系统紊乱:腹胀,胆管炎,消化不良,吞咽困难,呃逆,食管炎,大便失禁,胃肠胀气,胃炎,胃肠功能紊乱,胃肠道出血,口腔溃疡,胰腺炎,舌功能紊乱。全身:腹水,衰弱,细菌、真菌和病毒感染,出血,不适,粘膜疾病,疼痛,光敏反应,寒战,脓毒血症。肝功能紊乱:肝炎,黄疸。皮肤和附属物:脱发、皮肤干燥、出汗增多、荨麻疹。中枢和周围神经系统:做梦异常,健忘,焦虑,共济失调,昏迷,口干,情绪不稳定,运动过度综合征,张力亢进,性欲减退,肌阵挛,紧张,思睡,思维异常,震颤。肌肉-骨骼系统:肌肉骨骼疼痛,肌无力综合征。泌尿系统:血尿,阳痿,肾衰竭,尿频。代谢和营养:血碱性磷酸酶升高、血肌苷磷酸激酶升高、血糖降低、血乳酸脱氢酶升高、糖尿病、低蛋白血症。特殊感觉:弱视,失明,耳痛,眼出血,眼痛,失聪,青光眼,味觉紊乱,耳鸣,视觉异常,玻璃体异常。血液和淋巴系统:嗜酸性粒细胞增多,白细胞增多,淋巴结病,脾肿大。心血管系统:心律失常(包括室性心律失常)、偏头痛、静脉炎、心动过速、血栓性深静脉炎、血管扩张。呼吸系统:鼻窦充血。上市后发现的不良反应:有关更昔洛韦的不良反应:在以上各部分都没有提到的静脉和口服更昔洛韦上市后自发报告的不良事件,以下所列的是不能排除可能和更昔洛韦有关系的不良事件。由于盐酸缬更昔洛韦片被迅速的大量的转化为更昔洛韦,这些不良事件也可能在服用盐酸缬更昔洛韦片时发生:过敏反应;男性生育能力下降。上市后报告的不良事件与盐酸缬更昔洛韦片和更昔洛韦临床试验中观察到的不良事件是一致的。 |
| 禁忌 | 已知对缬更昔洛韦、更昔洛韦或药品中任何其他成分有过敏反应的病人不能应用盐酸缬更昔洛韦片。由于盐酸缬更昔洛韦片与阿昔洛韦(aciclovir)和伐昔洛韦(valaciclovir)的化学结构相似,这些药物之间可能存在交叉过敏反应。 |
| 注意事项 | 以更昔洛韦测定的盐酸缬更昔洛韦片的绝对生物利用度比更昔洛韦胶囊高10倍。盐酸缬更昔洛韦片不能1:1的代替更昔洛韦胶囊。以前应用更昔洛韦胶囊要改用盐酸缬更昔洛韦片片剂的病人,应被告知:如果服用超过处方剂量的盐酸缬更昔洛韦片,有药物过量的危险。(参见用量用法,药物过量)。在治疗过程中建议监测全血细胞计数和血小板计数。有严重白细胞减少,中性粒细胞减少,贫血和/或血小板减少的病人,建议采用血细胞生长因子治疗和/或考虑暂停服药(参见特殊剂量指南和不良反应)。对肾功能不全的病人,需要按照肌酐清除率调整剂量(参见特殊剂量指南和特殊人群的药代动力学)。对已进行血液透析的病人(CrCl<10mL/min),无法给出推荐剂量。因此盐酸缬更昔洛韦片不能用于此类患者(参见特殊剂量指南和特殊人群的药代动力学)。应用盐酸缬更昔洛韦片和/或更昔洛韦后有报道出现惊厥、镇静、头晕、共济失调和/或精神错乱。如果这些情况发生,可能会影响需要精力集中的活动,包括病人驾驶汽车和操作机器的能力。在合用亚胺培南-西司他丁(泰能)和更昔洛韦的病人中有发生惊厥的报道。盐酸缬更昔洛韦片不应该与泰能合用,除非可能获得的益处高于潜在的危险性(参见药物相互作用)。齐多夫定(Zidovudine)和盐酸缬更昔洛韦片单独应用都可能引起中性粒细胞减少和贫血。有些病人可能不能耐受全量合用这两种药(参见药物相互作用)。在与盐酸缬更昔洛韦片合用时,去羟肌苷(Didanosine)的血浆浓度可能会升高;因此应密切监测病人的去羟肌苷毒性(参见药物相互作用)。合用盐酸缬更昔洛韦片和其他已知有骨髓抑制或与肾功能不全有关的药物时,会导致毒性增加(参见药物相互作用)。 请仔细阅读说明书并遵医嘱使用。 |
| 相互作用 | 1.与盐酸缬更昔洛韦片的药物相互作用:在原位大鼠小肠的渗透性模型研究表明,缬更昔洛韦与伐昔洛韦,地丹诺辛,奈非那韦,环孢菌素,奥美拉唑和吗替麦考酚酯没有相互作用。 2.盐酸缬更昔洛韦片被代谢成更昔洛韦,因此和更昔洛韦的相互作用估计也会出现。 3.与更昔洛韦的药物相互作用:更昔洛韦的血浆蛋白结合率仅为1-2%,所以不会出现竞争蛋白结合位点的相互作用。 4.亚胺培南-西司他丁(泰能):合用更昔洛韦和亚胺培南-西司他丁有发生惊厥的报道。这两种药不应该合用,除非可能获得的益处远超过潜在的危险性(参见警告)。 5.丙磺舒(Probenecid):丙磺舒和口服更昔洛韦合用将导致肾脏对更昔洛韦的清除率有显著统计学意义的下降(20%),使机体对药物暴露有统计学意义地增加(40%)。这些变化的作用机制为竞争性的肾小管分泌。因此要对合用盐酸缬更昔洛韦片和丙磺舒的病人密切监测更昔洛韦的毒性。 6.齐多夫定(Zidovudine):当口服更昔洛韦的病人再合用齐多夫定时,齐多夫定的药时曲线下面积(AUC)稍有增加(17%),但有统计学意义。而且合用两药有使更昔洛韦血浓度降低的趋势,虽然无显著统计学意义。然而,由于齐多夫定和更昔洛韦都可能引起中性粒细胞减少和贫血,有些病人可能不能耐受全量合用这两种药(参见注意事项)。 7.去羟肌苷(Didanosine):当合用更昔洛韦(无论是静脉还是口服)时发现去羟肌苷的血浆浓度升高。更昔洛韦的口服剂量每日为3g和6g时,去羟肌苷的药时曲线下面积(AUC)升高84-124%;类似地,更昔洛韦的静脉用药剂量为5和10mg/kg/天时,去羟肌苷的药时曲线下面积升高38-67%。这种升高不能以肾小管的竞争性分泌解释,因为去羟肌苷分泌的百分比也升高了。这种升高可能由于生物利用度升高或是由于代谢降低。对更昔洛韦的血药浓度的影响无临床意义。然而由于两药合用时去羟肌苷的血药浓度升高,应密切监测病人去羟肌苷的毒性(参见注意事项)。 8.吗替麦考酚酯(Mycophenolatemofetil):基于单次口服推荐剂量的吗替麦考酚酯(MMF)和静脉应用更昔洛韦的研究结果,以及已知的肾功能不全对MMF和更昔洛韦药代动力学的影响,推测合用这两种药(有可能竞争肾小管分泌)会导致麦考酚酸的葡萄糖苯苷酸(MPAG)浓度和更昔洛韦的浓度升高。推测麦考酚酸(MPA)的药代动力学没有大的改变,因此MMF的剂量不需要调整。肾功能不全的病人如果合用MMF和更昔洛韦时,应观察更昔洛韦的推荐剂量,并密切监测病人。 9.扎西他滨(Zalcitabine):扎西他滨使口服更昔洛韦的药时曲线下面积AUC0-8增加13%,其他药代动力学参数无统计学意义的变化。此外,合用口服更昔洛韦时虽然扎西他滨的清除速率常数稍有增加,但药代动力学特点在临床上无相关的变化。 10.司他夫定(Stavudine):当合用司他夫定和口服更昔洛韦时没有发现药代动力学参数有统计学意义的相互作用。 11.甲氧苄氨嘧啶(Trimethoprim):甲氧苄氨嘧啶使口服更昔洛韦的肾清除率降低16.3%,有统计学意义,并相应的使终末清除率显著下降和半衰期延长15%。然而这些变化在临床上未必有意义,因为AUC0-8和Cmax不受影响。甲氧苄氨嘧啶与更昔洛韦合用时,甲氧苄氨嘧啶的药代动力学参数中唯一有统计学显著变化的是谷浓度Cmin增加12%。然而这一变化未必有临床意义,因此无需调整剂量。 12.环孢霉素(Cyclosporin):通过比较环孢霉素的谷浓度,没有证据表明更昔洛韦的使用影响环孢霉素的药代动力学参数。然而,有证据表明在开始更昔洛韦治疗后最大血清肌酐值升高。 13.其他可能的药物相互作用:当更昔洛韦与其它已知有骨髓抑制作用的药物或与肾功能不全有关的药物(如氨苯砜,戊烷脒pentamidine,氟胞嘧啶,长春新碱,长春花碱,阿霉素,二性霉素B,核苷类似物和羟基脲)合用时,毒性可能会增加。因此,只有在益处远大于危险性时才考虑更昔洛韦和这些药物合用(参见注意事项)。 |
| 贮藏 | 贮存于30°C以下。 |
| 有效期 | 36 月 |
| 批准文号 | 注册证号H20150330 |
| 生产企业 | PatheonInc. |
相关资讯
药品验真技巧
扫描药品追溯码查询真伪
目前市面上很多药品出厂的时候都会在药品外包装盒印上药品追溯码,如果您想验证药品真伪可以打开手机支付宝(微信不支持查询)对准药品追溯码扫一扫,如果扫描结果显示药品的详细信息,那么药品大概率为正品。如果没有扫描出信息,建议咨询销售商。
扫描条形码进行查询验真
由于不是全部药品外包装盒都有药品追溯码,所以如果药品外包装盒没有药品追溯码,那么可以用支付宝或者微信对准包装盒上的条形码扫一扫,真药会显示药品的相关信息,伪劣药品则不会显示。
查询国药准字号是否备案
市面上任何一款流通中的药品都会在国家药监局进行备案并获取批准文号,您可以打开国家药监局网站-选择数据查询-输入批准文号进行查询,如果查询不到备案信息,那么就有可能是伪劣药品。